A pandemia do novo coronavírus (SARS-CoV-2) apresenta desafios para a saúde pública, com consequências sociais e impactos científicos, técnicos e logísticos em todo o mundo. No Brasil, as estratégias de controle e enfrentamento da Covid-19 demandaram a ação conjunta de instituições e do poder público na ampliação da capacidade de testes. A fim de contribuir para realização do diagnóstico especializado – que possui custo elevado, além de mão de obra e infraestrutura especializadas –, desde 17 de abril, a Universidade Federal de Juiz de Fora, em parceria com a Prefeitura de Juiz de Fora, recebe amostras de pacientes e profissionais da saúde para realizar testes para o diagnóstico do coronavírus.
A pandemia do novo coronavírus (SARS-CoV-2) apresenta desafios para a saúde pública, com consequências sociais e impactos científicos, técnicos e logísticos em todo o mundo. No Brasil, as estratégias de controle e enfrentamento da Covid-19 demandaram a ação conjunta de instituições e do poder público na ampliação da capacidade de testes. A fim de contribuir para realização do diagnóstico especializado – que possui custo elevado, além de mão de obra e infraestrutura especializadas –, desde 17 de abril, a Universidade Federal de Juiz de Fora, em parceria com a Prefeitura de Juiz de Fora, recebe amostras de pacientes e profissionais da saúde para realizar testes para o diagnóstico do coronavírus.
Os espécimes clínicos são enviados pelo Sistema Único de Saúde (SUS), por meio da Secretaria Municipal de Saúde de Juiz de Fora, e analisados em dois laboratórios na UFJF: um localizado na Faculdade de Farmácia e, outro, no Instituto de Ciências Biológicas (ICB). Os exames impactam diretamente na mudança do quadro de subnotificação do município e nos registros da investigação epidemiológica da doença em Minas Gerais.
A seguir, confira a explicação da análise aplicada nas amostras e qual é o passo a passo dos exames desenvolvidos nos laboratórios da UFJF.
As análises são feitas por meio da técnica de RT-qPCR (Foto: Canva)
Explicando a análise
O protocolo de análise laboratorial utilizado na UFJF foi estabelecido pelo Centro de Controle e Prevenção de Doenças (CDC), agência do Departamento de Saúde e Serviços Humanos do Estados Unidos. As análises das amostras coletadas dos pacientes são feitas por meio da técnica de alta sensibilidade, a RT-qPCR. Enquanto “RT” significa “Transcriptase reversa”, a sigla PCR representa a Reação em Cadeia da DNA Polimerase, desenvolvida nos anos de 1980 e responsável por revolucionar diversas áreas da biologia e da medicina. Essa técnica é utilizada para a obtenção da amplificação seletiva de determinada região de uma molécula de DNA que, por si só, pode produzir milhões de cópias do DNA alvo. O “q” em “qPCR”, por sua vez, quer dizer “quantitativo”, ou seja, é possível saber a quantidade inicial de vírus em uma determinada amostra. Este tipo de PCR é usado para detectar, caracterizar e quantificar DNA ou RNA para diversas aplicações possíveis.
O professor José Otávio do Amaral, do Laboratório de Biologia Molecular da Faculdade de Farmácia, explica: “o teste consiste na avaliação de amplificação de duas regiões presentes no gene N do Sars-COV-2, denominadas de N1 e N2, além de um controle endógeno marcador de metabolismo em células humanas”. De acordo com a professora Vanessa Dias, do Centro de Estudos em Microbiologia do ICB (CEMIC), os exames em RT-qPCR são assertivos e indicados para testes de Covid-19 com base na alta taxa de confiabilidade, devido ao rigor dos processos científicos.
Do paciente ao laboratório
As amostras são coletadas da nasofaringe e da orofaringe dos pacientes – pelo nariz e pela garganta, respectivamente – com um cotonete estéril. Em seguida, os profissionais capacitados executam os protocolos necessários de conservação e transporte do material. Ao chegar no laboratório, as amostras são inspecionadas, cadastradas no sistema com os dados de cada paciente e seguem para processamento. A extração de RNA é realizada manualmente e, posteriormente, são utilizados insumos específicos para detecção do vírus, ampliando o material genético alvo em análise: o SARS-CoV-2. O processo de detecção do vírus utiliza reagentes para a inativação (fazer com que o vírus não seja contagioso), a extração do material genético e a realização das reações de amplificação (aumento do número de cópias do RNA viral). Ao fim do procedimento, os laudos são liberados.
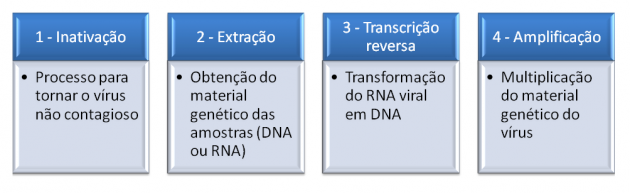
Etapas do processo de detecção do vírus
Inativação das amostras
Após a inspeção inicial e o cadastro, as amostras são preparadas para prosseguimento da análise laboratorial. “Após esta primeira checagem, separamos uma pequena quantidade da amostra e adicionamos a ela um reagente chamado trizol. Ele atuará na ruptura das membranas das células presentes na amostra, como as células do hospedeiro e as partículas virais, liberando seu conteúdo genético e ajudando na sua preservação para as próximas etapas”, esclarece a técnica-administrativa em educação (TAE), Suzane Fernandes, da equipe de diagnóstico do CEMIC.

As amostras são coletadas da nasofaringe e da orofaringe dos pacientes (Foto: Canva)
Extração do RNA
Dando sequência à inativação do material, há o processo de separação dos restos celulares e de partículas virais (debris) para que todo o RNA presente na amostra fique solubilizado em álcool. De acordo com professor e membro da equipe do CEMIC, Rodrigo Hohl, para separar o RNA são realizadas três centrifugações até que os debris fiquem precipitados ao fundo do tubo. Durante esta etapa, a intenção é de purificar e isolar o RNA de qualquer outro material que a amostra original possa conter. No fim, esse precipitado com RNA é solubilizado em água ultra-pura, livre de qualquer contaminante. Essa solução, então, segue para análise no equipamento de PCR em tempo real.
Análise de detecção PCR
Na última etapa do processo, é realizada a transcrição reversa seguida de reação em cadeia da polimerase (a RT-PCR), considerada o padrão-ouro no diagnóstico da Covid-19, de acordo com a pesquisadora também atuante no CEMIC, Michele Munk. Por meio dela, é possível detectar o material genético (RNA) do novo coronavírus na amostra analisada.
“Em suma, é um método baseado na transcrição reversa do RNA do vírus, transformando-o em DNA complementar, conhecido como cDNA, na linguagem técnica”, elucida Munk. “Na sequência à transformação, são inseridos primers, ou seja, fitas simples de DNA, e o material é amplificado. As fitas complementares hibridizam com a sequência alvo que, nesse caso, é o material genético viral do novo coronavírus, o SARS-CoV-2. Por fim, as sondas específicas emitirão um sinal que será captado pelo equipamento e confirmará a presença do coronavírus na amostra.”

A RT-qPCR é usada para detectar, caracterizar e quantificar DNA ou RNA para diversas aplicações possíveis.
O método faz uso de insumos específicos e de custo elevado. O tempo de montagem da placa e corrida das amostras no PCR em tempo real é de aproximadamente duas horas e meia. Somada, a capacidade dos dois laboratórios da universidade é de cem testes diários, com liberação de resultados em até 48 horas após o recebimento das amostras. O Laboratório de Biologia Molecular da Faculdade de Farmácia da UFJF tem como coordenadores Olavo dos Santos e Frederico Pittella Silva e responsável técnico José Otávio do Amaral. No CEMIC, Laboratório localizado no ICB, essas funções são exercidas pelos professores Aripuanã Watanabe e Cláudio Galuppo Diniz.
Distinção entre o teste PCR e o teste rápido
A diferença entre os testes PCR, realizados na UFJF, e os testes rápidos, disponíveis no mercado, encontra-se no material (espécime clínico) e na forma de análise. As amostras analisadas via PCR baseiam-se na pesquisa do RNA do novo coronavírus (genoma viral) durante o curso da doença. Já os testes rápidos consistem na pesquisa de anticorpos desenvolvidos contra o vírus, feitos a partir do soro em amostras de sangue que tornam-se detectáveis após a doença, ou mais ou menos de duas a três semanas da infecção.