Principais Drogas Esquistossomicidas 
Por: Lucas Sales Queiroz
Os tratamentos medicamentosos para esquistossomose sempre foram limitados pela dificuldade de se obter agentes quimioterápicos que demonstrem simultaneamente alta eficácia e tolerabilidade. O Tartarato de antimônio foi uma das primeiras drogas propostas para o tratamento da esquistossomose. Compostos de antimoniais eram, desde a antiguidade, indicados para o tratamento da hematúria, provavelmente causada pelo Schistosoma haematobium. Dentre os compostos antimoniais utilizados neste período podemos citar o dimercaptossuccinato de sódio e o antimônio e o di-(pirocatecol-2,4-dissulfonato) de sódio e antimônio, também conhecido como Estibofeno. O estibofeno pertence ao grupo dos antimoniais trivalentes sendo a primeira classe de drogas esquistossomicidas com um mecanismo de ação proposto. O mecanismo proposto foi a inibição da fosfofrutoquinase, enzima que catalisa a conversão de frutose-6-fosfato para frutose-1,6-difosfato, interferindo na via glicolítica dos parasitos1 .Apesar da alta eficiência no combate a três espécies do gênero Schistosoma, S. mansoni, S. haematobium e o S. japonicum, o estibofeno acabou se tornando um fármaco obsoleto no tratamento desta helmintose, devido aos seus efeitos colaterais como trombocitopenia e ulcerações pela pele, fazendo com que muitos pacientes abandonassem o tratamento2
Ao fim da Segunda Grande Guerra Mundial, a Lucantona (cloridrato de 1-N-b-dietil-amino-etil-amino-4-metil-9-tioxantona) e seu metabólito principal 1-N-b-dietil-amino-etil-amino-4 (hidroximetil)-9-tioxantona, a hicantona, começaram a ser utilizadas. Estas drogas foram descobertas com o apoio da Indústria Farmacêutica, mais especificamente a Bayer, em um programa de pesquisa de agentes esquistossomicidas que teve início em 1938 por Kikuth e Gönnert3. Em agosto do mesmo ano, surgiu o primeiro composto sintetizado como resultado dessa parceria, o Miracil A. Nos anos subsequentes três outros compostos da mesma série ainda seriam sintetizados o Miracil B, C e D, sendo o Miracil D o composto introduzido na prática clínica com o nome genérco de Lucantone, eficaz no tratamento contra S. mansoni e S. haematobium. Os efeitos colaterais do Lucantone, no início, se resumiam a simples náuseas e vômitos, até surgirem ocasionais alterações cardiovasculares e no SNC, o que acabou levando a complicações em relação ao uso destes medicamentos.
Em 1964 surge uma nova alternativa em relação aos antimoniais, o fármaco Niridazol, introduzido pela Ciba-Geigy com o nome Ambilhar, tendo a vantagem de ser um fármaco administrado por via oral e indicado principalmente para o tratamento contra S. haematobium4. Em contra partida o niridazol deveria ser administrado em múltiplas doses e apresentava indesejáveis efeitos colaterais, dentre eles, toxicidade central, carcinogenicidade e imunossupressão. A imunossupressão foi relacionada posteriormente ao metabólito 1-tio -carbamoil-2-imidazolidinona que é produto do metabolismo redutivo carreado por bactérias anaeróbias e também pelo S. mansoni adulto5. O mecanismo de ação do niridazol foi proposto por Tracy e colaboradores em 1983, onde verificou-se a necessidade de uma redução do grupo nitro do niridazol pela presença de NADPH em condições anaeróbicas. Desta forma seria possível ocorrer a ligação do fármaco covalentemente a macromoléculas do parasita.
- Surgimento dos atuais fármacos de primeira e segunda escolha:
Ainda na década de 60 surge um composto derivado do Triclorfon, um organofosforado que já apresentava uma atividade anticolinesterasica reconhecida desde 1950. Esse composto ficou conhecido como Metrifonato ou Bilarcil, que apresenta atividade sobre o S. haematobium. Porém, a estrutura do metrifonato é instável em solução aquosa, sofrendo transformações espontâneas em vários outros compostos, destacando-se os diclorvos, 2,2-diclorovinil dimetil fosfato, que foram reconhecidos como sendo a forma bioativa, o que então classificou o metrifonado como um pró-fármaco6.Estudos químicos revelam que o grupo diclorovinil do diclorvos é importante para transesterificação com grupo álcool de resíduos da serina em proteínas, e que este tipo de esterificação no sítio ativo da acetilcolinesterase é responsável pela atividade inseticida e anti-helmíntica do diclorvos7.
Durante os anos de 1960 a classe dos nitrofuranos também tiveram sua atividade explorada por pesquisadores chineses frente ao S. japonicum. Como Um exemplo de fármaco dessa classe podemos citar o fluropomidium, que foi muito usado na China mas devido aos seus efeitos tóxicos o fármaco acabou sendo abandonado8.
Finalmente é apresentado o produto da oxidação microbiológica do UK3883 pelo Aspergillus sclerotiorum, graças ao programa de pesquisa de Kikuth e Gönnert, o fármaco 6-hidroximetil-2-isopropilaminometil-7-nitro-1,2,3,4,-tetra-hidroquinolina ou Oxamniquine. O UK3883 é o metabólito ativo do Mirasan, um composto análogo estrutural do lucantone que foi proposto e que se mostrou ativo nas pesquisas desenvolvidas pela indústria Bayer9. O Oxamniquine (Mansil), produzido pela Pfizer na Grã-Bretanha, com matéria-prima fornecida pela Sterling Winthrop, é bem absorvido por via oral alcançando pico máximo de concetração plasmática 1,5 horas após a administração e apresenta meia-vida plasmática de 1 a 2,5 horas. Em relação a sua ação esquistossomicida os machos são mais suscetíveis que as fêmeas, mas após o tratamento com oxamniquina as fêmeas restantes cessam a postura de ovos, perdendo desta maneira o seu significado patológico sob o ponto de vista parasitológico10.
O oxamniquine apresentou bons resultados principalmente contra a espécie S.mansoni. Com relação aos efeitos adversos, os efeitos colaterais mais comumente observados foram tonturas e sonolência, náuseas, vômitos cefaleias e febre. Em relação ao lado neuro-psíquico o pesquisador Dr. Naftale Katz, um dos grandes especialistas em esquistossomose, e pesquisador do Instituto Renê Rachou, de Belo Horizonte, foi o primeiro a chamar a atenção para alguns casos de alucinação e excitação psíquica observados entre uma e duas horas após a administração11.Foram constatado posteriormente, casos de convulsões epileptiformes dentro das primeiras horas de administração do fármaco, o que exigiu maior atenção em relação ao uso e a dose de administração do oxmniquine. Foi observado que o oxamniquine exerce efeito de bloqueio dos receptores da acetilcolina e inibição irreversível da síntese de ácidos nucléicos, tal qual ocorre com o hicantone12. 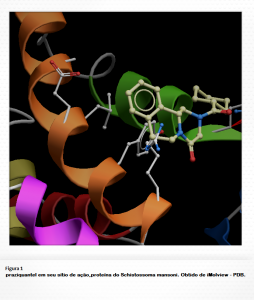
A partir de investigações da Bayer, desde o início da década de 1970 ao estudar a atividade anti -helmíntica de compostos tranquilizantes, o combate a esquistossomose ganha um novo impulso com a introdução do praziquantel, quimicamente o 2-ciclo-hexilcarbonil-1,2,3,6,7,11b-hexa-hidro-4Hpirazino-[2,1-a]isoquinolin-4-ona13,14. O praziquantel além de ser usado no tratamento de infecções por esquistossomose, mostra-se bastante eficaz na maioria das outras infecções por trematodeos e cestodeos, incluindo a cisticercose. É um fármaco bem absorvido com biodisponibilidade de cerca de 80% por administração oral. Apresenta picos de administração sérica entre 1 a 3 h após uma dose terapêutica. É um fármaco bem distribuído no SNC sendo, por isso, indicado no tratamento da neurocisticercose. O praziquantel sofre efeito de primeira passagem no fígado sendo metabolizado em produtos mono e polihidroxilados. A meia-vida é em torno de 0,8 a 1,5 h e sua excreção é feita principalmente pelos rins, cerca de 80%, e bile ,15 a 35%. As concentrações plasmáticas da droga podem aumentar se administrados juntamente com uma refeição rica em carboidratos.
Alta eficácia contra todas espécies de Schistosoma, ausência de efeitos colaterais sérios, administração de dose oral única, custo competitivo e larga experiência clínica mostrando que ele é seguro, efetivo e fácil de administrar, fizeram do praziquantel a droga de escolha no combate a esquistossomose. O mecanismo de ação do praziquantel está relacionado ao influxo cálcio através do tegumento e das células musculares do schistosoma causando contração imediatas, devido aos sítios no tegumento do verme que são sensíveis ao praziquantel. Como o tegumento está eletricamente ligado às células do músculo, uma elevação de cálcio intrategumentar conduz a um aumento do cálcio no retículo sarcoplasmático, promovendo assim a referida contração muscular15. Parasitos desprovidos de tegumento também sofriam ação do praziquantel mostrando contração. Outros fatores observados sobre a ação da droga foram alterações morfológicas como vacuolização do sincício tegumentar e a formação de bolhas na superfície do tegumento16. Com a formação dessas lesões no tegumento, ocorre a exposição de antígenos do parasito e a consequente penetração de células de defesa em seu interior que auxiliam na destruição dos vermes, este fato é decorrente pelo sinergismo entre a ação dos anticorpos e o praziquantel.
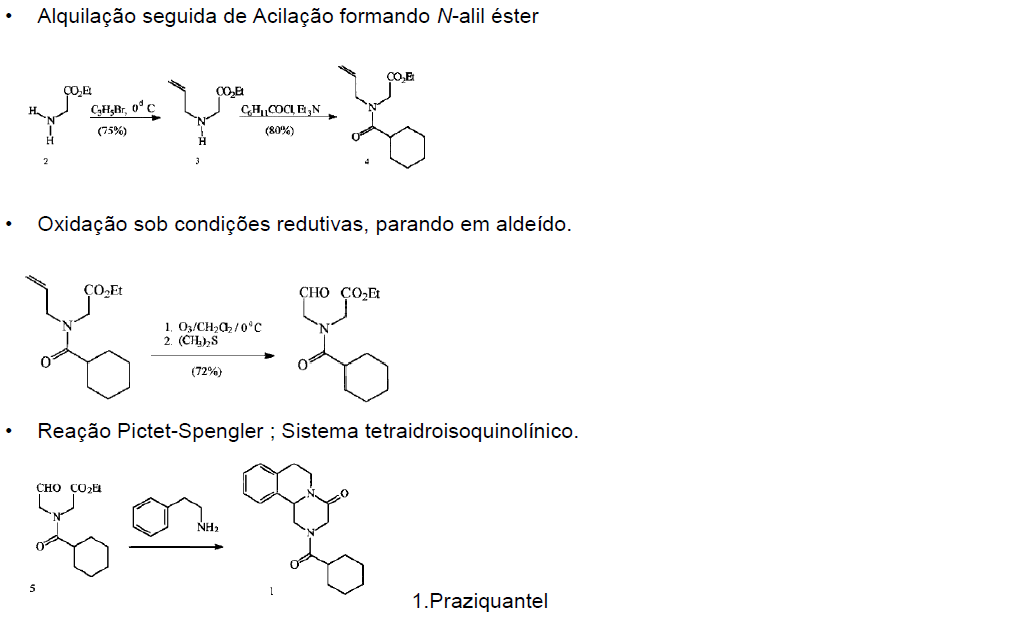
- Síntese do Praziquantel a partir da glicina:
Muitas sínteses químicas para obtenção do praziquantel patenteadas pela indústria farmacêutica, foram apresentadas de forma incompleta. Como a esquistossomose é uma parasitose de grande importância socioeconômica por ser endêmica em países subdesenvolvidos, torna-se um desafio acadêmico propor uma síntese completa, simples e econômica, que possibilite a obtenção do praziquantel com um bom rendimento, tornando-o cada vez mais acessível a população. Desta forma surgiu a síntese do praziquantel a partir da glicina, figura 2, como material de partida, destacando-se por sua simplicidade, embora necessite de otimização do rendimento global13.
Figura 2 . Síntese do Praziquantel.Retirado de NOVAES,M.R.C.G ; SOUZA, J.P ; ARAUJO, H.C. (1999).
Apesar do Importante passo dado a quase trinta anos no tratamento da esquistossomose, com a introdução do praziquantel no tratamento dessa helmintose, ainda hoje no mundo, das 200 milhões de pessoas infectadas, 120 milhões são sintomáticas e 20 milhões desenvolvem a forma grave da doença Como consequência do uso em massa do praziquantel como fármaco de primeira escolha e o oxamniquine como de segunda escolha, na maioria das áreas endêmicas, acabou surgido um perigo potencial que são as cepas de Schistosoma praziquantel-resistentes e oxamniquine-resistentes17. Diante destes casos de resistência ao fármaco, indisponibilidade da vacina e a migração de populações das áreas endêmicas, a busca de novas drogas esquistossomicidas tem se mostrado como uma grande necessidade mundial, assim como investimentos por parte do governo em saneamento básico e educação sanitária nas escolas e principalmente nas populações mais carentes, a fim de se evitar novos focos da doença e consequente expansão dos casos de esquistossomose no mundo.
REFERÊNCIAS:
|
1BUEDING, E., MANSOUR, J.M. (1957) The relationship between inhibition of phosphofructokinase activity and the mode of action of trivalent organic antimonials on Schistosoma mansoni. British Journal of Pharmacology andChemotherapy. 12: 159-165. |
|
|
2CIOLI, D., PICA-MATTOCCIA, L., ARCHER, S. (1995) Antischistosomal drugs: past, present … and future? Pharmacology & Therapeutics. 68: 35-85. |
|
|
3KIKUTH, W., GÖNNERT, R. (1948) Experimental studies on the therapy of schistosomiasis. Annals of Tropical Medicine and Parasitology. 42: 256-267. |
|
|
4 LAMBERT, C.R. (1964) Chemotherapy of experimental Schistosoma mansoni infection with a nitro-thiazole derivative CIBA 32,644-BA. Annals of Tropical Medicine and Parasitology. 58: 292-303. |
|
|
5CATTO, B.A., TRACY, J.W. AND WEBSTER, L.T. (1984) 1-Thiocarbamyl-2-imidazolidinone, a metabolite of niridazole in S. mansoni. Molecular and Biochemical Parasitology. 10: 111-120. |
|
|
6NORDGREN, I., HOLMSTEDT, B., BENGTSSON, E., FINKEL, Y. (1980) Plasma levels of metrifonate and dichlorvos during treatment of schistosomiasis with Bilarcil. American Journal of Tropical Medicine and Hygiene. 29: 426-430. |
|
|
7HOFER, W. (1981) Chemistry of metrifonato and dichlorvos. Acta Pharmacologica et Toxicologica. 49 S(V): 7-14. |
|
|
8KIKUTH, W., GÖNNERT, R. (1948) Experimental studies on the therapy of schistosomiasis. Annals of Tropical Medicine and Parasitology. 42: 256-267.
|
|
|
9RICHARDS, H.C., FOSTER, R. (1969)A new series of 2 aminomethyltetrahydroquinoline derivatives displaying schistosomicidal activity in rodents and primates. Nature. 222: 581-582.
|
|
|
10KATZUNG , B. G. Farmacologia Básica e Clínica. Porto Alegre: Artmed, 2010. |
|
|
11KUCINSKI. A História Se Repete. Disponível em: http://kucinski.com.br . Acesso em :10 jan.2014.
|
|
|
12PICA-MATTOCCIA, L., CIOLI, D. (1983) Effect of hycanthone administered in vivo unpon the incorporation of radioactive precursors into macromolecules of Schistosoma mansoni. Molecular and Biochemical Parasitology. 8: 99-107 |
|
|
13NOVAES,M.R.C.G ; SOUZA, J.P ; ARAUJO, H.C. (1999) Síntese DO Anti-Helmíntico Praziquantel, A Partir Da Glicina. Química Nova, 22: 1-10
|
|
|
14 SEUBERT, J., POHLKE, R., LOEBICH, F. (1977) Synthesis and properties of praziquantel, a novel broad spectrum anthelminthic with excellent activity against schistosomes and cestodes. Experientia. 33: 1036-1037. |
|
|
15THOMPSON, D.P., PAX, R.A., BENNETT, J.L. (1982) Microelectrode studies of the tegument and subtegumental compartmentes of the male Schistosoma mansoni: an analysis of electrophysiological properties. Parasitology. 85:163-178. |
|
|
16XIAO, S.H., FRIEDMAN, P.A., CATTO, B.A., WEBSTER, L.T. (1984) Praziquantel-induced vesicle formation in tegument of male Schistosoma mansoni is calcium dependent. The Journal of Parasitology. 70: 177-179. |
|
|
17CIOLI, D., PICA-MATTOCCIA, L., MORONI, R. (1992) Schistosoma mansoni: hycanthone/oxamniquine resistance is controled by a single autosomal recessive gene.Experimental Parasitology. 75: 425-432. |